Mættet vanddamp - hvorfor er det ikke en ideal gas?
Hej Spørg om Fysik
Jeg har et spørgsmål med hensyn til mættet vanddamp. Hvorfor er det ikke en ideal gas?
Hvordan skal man forstå denne tekst: "alveoleluften er mættet med vanddamp, hvis tryk kun afhænger af temperaturen - mættet vanddamp følger således ikke luftarternes tilstandsligning" - hvad med n/V ?
Daltons lov foreskriver, at det totale tryk i en (ideal)gasblanding er lig med summen af partialtryk fra de gasser, der er i blandingen. Ptotal = P1 + P2 + P3 + ... + Pn - må PH2O vanddamp indsættes i denne ligning, da det ikke er en ideal gas?
På forhånd mange tak
Med venlige hilsener
AL
Vanddamp er ikke nogen særlig ideal gas, der er afvigelser fra idealgasloven, men de er moderate. Der er også andre luftarter, som har afvigelser der er fra ideal gasloven, f.eks. CO2 (carbondioxid) og NH3 (ammoniak).
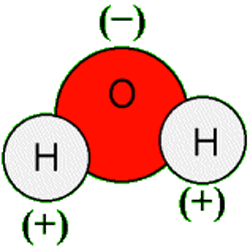
Vandmolekyle
Vand er generelt set et ret unormalt stof. Det skyldes især de hydrogenbindinger, der opstår, herunder også at molekylet er vinklet med ilt til den ene side, og de to brintatomer til den anden. Det betyder, at molekylet er polært, og får en negativ (oxygen) og positiv (hydrogen) side. Vinklen imellem hydrogenatomerne er 104,45 ˚.
Molekylets form bevirker, at vand har en høj relativ permittivitet (dielektricitetskonstant), som omkring 78 ved stuetemperatur (88 ved 0 ˚C) faldende til 55 ved 100 ˚C. Det er bl.a. denne egenskab, der gør vand til et godt opløsningsmiddel, f.eks. for syre og salte, som kan spaltes i ioner. Disse hydrogenbindinger giver også vand et højt kogepunkt i forhold til kemisk lignende stoffer som H2S.
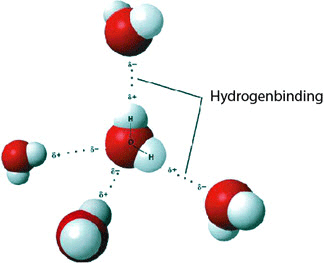
Hydrogenbindinger
Vand har også en høj specifik varmekapacitet af denne grund. Det er derfor, at vand er et godt stof at oplagre varmeenergi i (som i solfangerbeholdere). Endeligt har vand en stor fordampningsvarme, som gør det velegnet i dampturbiner m.v.
Ideale gasser
Forudsætningen for idealgasloven, som der henvises til er, at molekylerne er punktformige (at de ikke fylder noget), og at de kun vekselvirker ved at støde elastisk sammen. Hverken det ene eller andet er tilfældet for vanddamp, bl.a. på grund af molekylets polaritet. Til ideale gasser kan vi stort set kun helt henregne ædelgasser ved forholdsvis lave tryk. For vanddamp er der ved præcise målinger en række afvigelser, fra de forventede værdier.

Johannes Diderik van der Waals
Man har en bedre model for en gaslov: Van der Waals gasloven, Johannes Diderik van der Waals (NL, 1837 – 1923), der bl.a. tager hensyn til at molekylerne ikke er punktformige.
Mættet vanddamps tryk
Det er imidlertid et helt andet problem end brug af idealgasloven, når man har en gas i ligevægt med sin væske eller sit faste stof. Vanddamp i ligevægt med en vandmængde har et tryk, som kun afhænger af temperaturen af vand og vanddamp (det samme gælder naturligvis sprit med spritdamp over og alle andre væsker). Det betyder, at dette ikke er et tilfælde, hvor man kan anvende luftarternes tilstandsligning, til bestemmelse af trykket i et givet rumfang.
Det der gælder, fås fra en damptrykskurve, som hosstående figur fra Bergmann Schaefers fysik. Her fremgår det, at trykket, uafhængigt af rumfanget, kun afhænger af temperaturen. Holder man temperaturen fast, og mindsker rumfanget, vil der kondenseres vanddamp til flydende vand, indtil trykket igen er det anførte. Omvendt, forøges rumfanget, fordampes vand tilsvarende til samme tryk. Dette fortsætter indtil der enten ikke mere er vanddamp over vandet, og så stiger trykket enormt, hvis man trykker sammen, fordi en
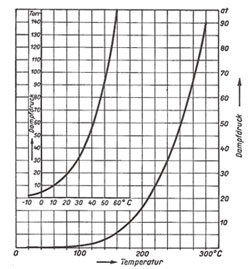
Mættet vanddamps tryk (fra Bergmann Schaefer)
væske er vanskelig at sammentrykke. Alternativt er trykket konstant indtil alt flydende vand er fordampet, og så gælder idealgasloven pludselig i stedet (så ideal, som vand nu engang er).
Luftfugtighed
Når man har vanddamp i luft gælder Daltons lov, så længe vanddampen er langt fra at være mættet. Atmosfærisk luft kan ved en given temperatur indeholde en vis maksimal mængde vanddamp. Søges vanddampmængden forøget ud over dette, kondenserer vandet ud i væskeform. Det er bl.a. det, der kan skabe tåge ved vejrforandringer.
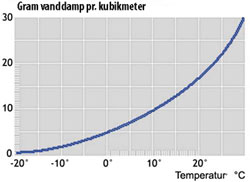
Luftfugtighed
Man kan altså ikke i ligevægt bestemme sig for et vilkårligt vanddamptryk i atmosfærisk luft, kun hvis det er mindre end mættet vanddamps tryk ved den pågældende temperatur. Dette sidste er altså svar omkring alveoleluft, der må ikke være mættet vanddamp eller flydende vand i ligevægt med systemet. Samtidigt, så længe man er langt fra mættet vanddamp, kan man anvende Daltons lov.
Med venlig hilsen
Malte Olsen
