Isotoper og zink
 Hej Spørg om Fysik
Hej Spørg om Fysik
Jeg vil spørge om hvordan man betegner en given ISOTOP. En ISOTOP af eksempelvis Jern. I Grundstoffernes periodiske system (Bogen om Grundstoffer af Gyldendal) kan jeg se at elektrontallet er nævnt, "skallernes" atomnummer, kemisk navn men hvor er ISOTOPERNE ?
-
Hvilken molekylestruktur har Zink?
-
Hvad bestemmer et grundstofs smeltepunkt ?
-
Har det med molekylestrukturen eller Atomets opbygning at gøre ?
Billedet er fra LIFE: Stof og materie.
På forhånd tak for svar
E K J
Atomerne, som vi er sammensat af, har alle en atomkerne og desuden elektroner omkring kernen.
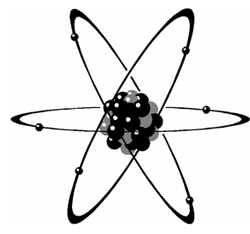 I kernerne er der protoner og et varierende antal neutroner, normalt nogenlunde lige så mange neutroner som protoner for de lette stoffer, men når man når op i de tungere stoffer, bliver der forholdsvis flere neutroner pr. proton. Uden om atomkernen i det neutrale atom er der en sky af elektroner, lige så mange som der er protoner, så atomet er elektrisk uladet samlet. Protonerne og neutronerne vejer stort set lige meget. Elektronerne vejer ca. 1/2000 del af protonmassen, så hele atomets masse er samlet i kernen.
I kernerne er der protoner og et varierende antal neutroner, normalt nogenlunde lige så mange neutroner som protoner for de lette stoffer, men når man når op i de tungere stoffer, bliver der forholdsvis flere neutroner pr. proton. Uden om atomkernen i det neutrale atom er der en sky af elektroner, lige så mange som der er protoner, så atomet er elektrisk uladet samlet. Protonerne og neutronerne vejer stort set lige meget. Elektronerne vejer ca. 1/2000 del af protonmassen, så hele atomets masse er samlet i kernen.
Kemiske egenskaber
Det der bestemmer de kemiske egenskaber er de yderste elektroner. Elektronerne ligger i "kugleskaller" omkring atomkernen, kvantemekanikken fortæller, at der kun kan være et bestemt antal elektroner pr. skal. Når en skal er fyldt er den meget stabil. De kemiske egenskaber bestemmes ikke af de elektroner, der er tættest på kernen men af de yderste, de indre skaller sidder så tæt på kerneladningen, at de er meget fast bundet til kernen. I det store og hele er det for de fleste stoffer de 0-7 yderste elektroner, der er ansvarlige for de kemiske egenskaber, for få stoffer er der dog elektroner i den næstyderste skal, der også har betydning.
Isotoper
Forskellige kerner kan have samme kemiske egenskaber, dem kalder man isotoper. Da de kemiske egenskaber afhænger af antal elektroner, og dermed det dertil svarende antal protoner, består forskellen i antal neutroner. Tager man det simpleste atom, som er brint eller hydrogen, er den almindelige form for hydrogen 1 proton og en elektron udenom. Det er den type hydrogen, som er en af hovedbestanddele i vor krop og i f.eks. vand. Der findes en anden form, tungt brint, som også hedder Deuterium, som har en proton og en e neutron atter med en elektron udenom. I naturen er det 0,0156 % af hydrogenen. Der findes en tredje form, en proton og to neutroner med en elektron udenom, den kaldes tritium. Den er radioaktiv og henfalder på 12,5 år med et betahenfald (udsendelse af en elektron fra kernen). Disse tre stoffer er alle isotoper af Brint/hydrogen og har næsten ens kemi. Da hydrogen er så let og ekstra neutroner gør en stor forskel, er kemi og biologi kun næsten ens, spiser man mad med meget deuterium opstår der forskellige sygdomme, fordi deuterium ikke helt giver samme molekyler i facon som almindelig brint. Du nævner jern, som er grundstof nr. 26, dvs. 26 protoner og elektroner. I naturen har 91 % af jernet 30 neutroner, 5,90 % har 28 neutroner, 2,245 % har 31 neutroner og 0,53 % 32 neutroner, ingen af disse isotoper er radioaktive. For Zink, som er nr. 30 (30 protoner), er der 5 isotoper, 48,87% med 34 neutroner, 27,62 %, 36 neutroner, 4,12 %, 37 neutroner 18,71 %, 38 neutroner og 0,69% med 40 neutroner. Alle er stabile. Man kan med acceleratorer og med kernereaktorer fremstille en række isotoper, som ikke findes i naturen, så der kendes i alt 12 isotoper for Zink og 8 for jern. De på den måde fremstillede er i reglen radioaktive og henfalder, så grunden til at de ikke findes i naturen kan være, at de er forsvundet ved henfald fra jordens skabelse til nu (4,5 milliarder år). Nogen få radioaktive stoffer er langlivede, det gælder de meget tunge stoffer f.eks. uran, men også stoffer som vi skal have for at leve, f.eks. har kalium en isotop der hedder kalium 40 (kalium nr. 19 den har altså 21 neutroner), som har en halveringstid på 1,4 milliarder år, og som findes i naturligt kalium som 0,0119 %. Der er stoffer som kun har en isotop i naturen f.eks. Fluor og Mangan.
Zink
Det er altså stof nr. 30 og har det kemiske symbol Zn. Det er forholdsvis almindelige og udgør ca. 0,007 % af jordens skal ofte i form af zinksulfid. Det er et forholdsvis hårdt sølvfarvet metal. I luften får det en iltcoatning som forhindre videre reaktion, så det bruges til at beskytte andre metaller f.eks. jern imod rust i form af galvanisering. Det anvendes også i tørelementer. Det kan fosforiscere ved elektronbestråling og indgik derfor i TV og katodestrålerørs lysende overflader (TV billedrør og gammeldages computerskærme). Ovenfor blev det omtalt, at elektronerne ordnede sig i skaller eller niveauer, for Zink er der 2 elektroner i den inderste niveau, 8 i næste, 18 i tredje og 2 i det yderste niveau, som altså bestemmer de kemiske egenskaber. Det får det kemisk til at ligne de stoffer, som har to elektroner i yderste niveau, det er f.eks. cadmium og kviksølv, men også lidt calcium og barium
Metallers egenskaber
Zink er et metal og har metallers egenskaber, det betyder at zinkatomerne i det faste stof forbinder sig til hinanden i noget, man kalder en metalbinding. Det har stor elektrisk ledningsevne og varmeledningsevne (i forhold til ikke metaller). Dette skyldes, at metaller deler deres yderste elektroner (2), så de flyder rundt i hele metalstykket, og altså bevæger sig meget frit (i modsætning til ikke metaller). Disse elektroner er også grunden til at metaller er uigennemsigtige for lys, de spejler elektromagnetisk stråling, Metallers egenskaber afhænger meget af det, man kalder ionradier, dvs. størrelsen af en metalion. For zink er afstanden imellem zinkatomer i metal omkring 131 pm (pm = picometer, det er et 0, 000000000001 m) - det tilsvarende tal for natrium er 186 pm, for er den stor får man metaller med lav densitet (massefylde), f.eks. Litium, Natrium og Kalium. Hvis densiteten er under 3 kaldes metallet letmetal, nogen metaller , tungmetaller, har meget små ionradier og meget høj densitet f.eks. Osmium, Irridium og platin, som er oppe med densiteter omkring 22 (22 tons pr. kubikmeter). Tilsvarende varierer smeltepunkterne fra kviksølv med - 38,8 ⁰C til wolfram på 3422 ⁰C. Zink har et smeltepunkt på 419,527 ⁰C.
Opbygning
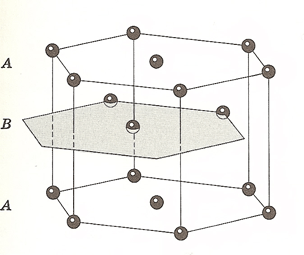 I metallet ligger atomerne på samme måde, som ens bolde der lægges ovenpå hinanden i mange lag, dvs. radierne i et lag rammer hinanden og laget ovenover ligger ned i hullerne i første lag osv (det kaldes hcp opbygning). Det der altså bestemmer smeltepunkter mm., er afstanden imellem atomerne, som igen afhænger af bindingernes styrke (hvor kraftigt er atomerne bundet sammen i metallet, hvor tæt ligger de). Mere præcist er det sådan at stor bindingsenergi giver høje smeltepunkter (bindingsenergi er stort set den energi man skal tilføre, for at bryde bindnigen)
I metallet ligger atomerne på samme måde, som ens bolde der lægges ovenpå hinanden i mange lag, dvs. radierne i et lag rammer hinanden og laget ovenover ligger ned i hullerne i første lag osv (det kaldes hcp opbygning). Det der altså bestemmer smeltepunkter mm., er afstanden imellem atomerne, som igen afhænger af bindingernes styrke (hvor kraftigt er atomerne bundet sammen i metallet, hvor tæt ligger de). Mere præcist er det sådan at stor bindingsenergi giver høje smeltepunkter (bindingsenergi er stort set den energi man skal tilføre, for at bryde bindnigen)
Billedet er fra C. Kittel: Solid state physics . Det viser de to ens lag A og A med et lag atomer imellem B som er forskudt og drejet i forhold til A-lagene men ellers identisk med disse.
Med venlig hilsen
Malte Olsen
