Hydrogens linjespektrum
Hej Spørg om Fysik
Er det muligt at få svar på følgende spørgsmål:
Hydrogens liniespektrum fremkommer jo ved, at elektronerne afgiver lyskvanter ved overgang fra højere energiniveauer til lavere energiniveauer - fx Balmer-serien til energiniveau n2.
Hvis fx en hydrogengas udsættes for energitilførsel i form af 5000 V, exciteres elektronerne til højere energiniveauer (max 7). Er det så korrekt, at elektronerne i de forskellige H-atomer exciteres op i forskellige niveauer, og derefter falder tilbage til lavere niveauer under udsendelse af fotoner m. forskellige bølgelængder - og hvorfor exciteres elektronerne i H-gassen ikke alle op til samme energiniveau - og alle falder tilbage til tidligere niveau?
Med venlig hilsen
J R D
Hydrogen består under normale forhold af to protoner bundet sammen af 2 elektroner. Ser vi på atomet, 1 proton med en elektron omkring i grundtilstanden, ioniseres det ved tilførsel af en energi på 13,6 eV, dvs. elektronen kan blive slået helt væk fra protonen af denne energi, så protonen bliver tilbage med sin ene positive ladning.
Hvis vi sætter energien af det ioniserede hydrogenatom til 0J har elektronen i grundtilstanden altså den negative energi: E =- 13,6 eV = -2,18 * 10-18 J (eV betyder elektronvolt og 1 eV er den energi en elektron får ved at passere et spændingsfald på 13,6 V).

Hydrogen linjespektrum i absorption og emmission
Elektroner der har passeret et spændingsfald på 5000 V, har altså energi til at ionisere hydrogenatomet, men afhængigt af præcist hvordan sammenstødet imellem den indkomne elektron og hydrogenatomet sker, vil alle energiniveauer under ionisering kunne nås.
Elektroner vil bevæge sig fra rørets negative pol imod den positive. På vejen støder de ind i mange hydrogenatomer, stoppes og får fart igen. De kan altså ramme et hydrogenatom med alle mulige forskellige energier. De negative lette elektronerne tiltrækkes naturligvis af protonens positive ladning, og de kan lande i det laveste niveau, men der vil ske en kompliceret serie af sammenstød imellem elektroner og protoner, så de kan lande i højere niveauer, og derefter måske i et eller flere hop falde ned til grundtilstanden.

Johann Jakob Balmer
Der findes også en række kvantemekaniske regler, som kan påvirke processen. Man får altså mange spektrallinjer frem ved processen. Hvis de 5000 V tilføres i form af, at der sker en udladning igennem en hydrogengas ved lavt tryk, vil mange af elektronerne have langt mindre energi end svarende til 5000 eV, som følge af stød med hinanden, glaskolben, protoner osv. Der kommer et antal serier af linjer, som bl.a. kaldes Balmer-serien, Lyman-serien, Paschen-serien Brackett - serien og Pfund - serien efter de respektive opdagere eller udmålere af bølgelængderne. Den kendteste serie er nok Balmerserien, som er den eneste i synligt område og som var den Niels Bohr opstillede sin kvanteteori ud fra.

Anders Jonas Ångström
(Sc, 1825 - 12, 1898) blev uddannet som fysiker og matematiker og var uddannet på en række Tyske og Schweiziske universiteter, men underviste i hele sit arbejdsliv på en Schweizisk pigeskole og som forelæser på Basel universitet. I 1885 opstillede han en empirisk formel for hydrogens linjespektrum, idet han anvendte Anders Jonas Ångström (S, 1814 - 1874) udmåling af hydrogenlinjerne. I det synlige spektrum består Balmer serien af de anførte linjer, de første af de ultra violette linjer er medtaget:
Den sidste søjle er den der fremkommer ved ionisering.

Balmers empiriske formel kan skrives: 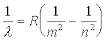
Hvor lambda er bølgelængden, R = 1,097 * 107 m-1 en konstant der afhænger af de enheder, man måler bølgelængden i, den kaldes Rydbergkonstanten, m er 2, n et helt tal større end 2 op til uendelig.
Med venlig hilsen
Malte Olsen
