Kræfter i stoffer
Hej Spørg om Fysik
Jeg er ved at skrive en bog, og i denne skal jeg finde "tekniske" forklaringer på superkræfter.
Jeg har styr på de 4 fundamentale naturkræfter, den svage kernekraft, elektromagnetiske (nogle kæder disse to sammen), den stærke kernekraft og tyngdekraften.
MEN: Jeg er på jagt efter hvad man kalder den kraft der holder atomerne i f.eks. en klump jern sammen. Jeg kender http://da.wikipedia.org/wiki/Valens valenskraften i kemiske forbindelser, men er det samme kraft der holder rene grundstoffer sammen? Er det samme kraft?
Med venlig hilsen
F D

Der er kun kendt de fire nævnte kræfter (idet evt. kræfter omkring mørkt stof ikke er præcist kendte endnu men de har næppe betydning for dette spørgsmål).
Til syvende og sidst er det de elektriske kræfter som holder sammen på atomerne i alle molekyler og faste stoffer. Når man taler om kræfter, tænker man som regel på noget, som indgår i Newton's 2. lov. Men elektronerne i atomer, molekyler og faste stoffer følger ikke Newtons love men i stedet er deres opførsel bestemt af kvantemekanikken. Kombineres kvantemekanik og elektriske kræfter får man derfor ofte ganske fremmedartede forklaringer på, hvorfor atomerne hænger sammen.
Her følger nogle få eksempler.
Ionbinding
Her er det de modsat ladede ioner der tiltrækker hinanden med coulombske kræfter f.eks. gælder det NaCl eller kogsalt. Kvantemekanikken spiller ikke nogen afgørende rolle her, og man kan benytte simple klassisk fysiske forklaringer. Da coulombkræfter er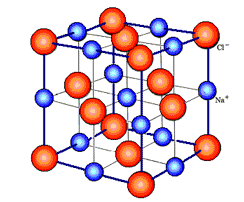 kuglesymmetriske ud fra en given ion f.eks Na+ vil den søge at omgive sig med ioner med modsat fortegn her Cl- på en symmetrisk måde indenfor de muligheder som pladsen tillader. Samtidigt skal det samlede slatkrystal have lige mange positive og negative ladninger. De ladede ioner fortættes i et gitter når det er fast stof, her noget man generelt kalder et kubisk gitter (atomerne sidder skiftevis Na og Cl som hjørner i enkasse som fortsætter i næste kasse udad, se figur. Stoffer med ionbindinger er i reglen opløselige i vand og ledende. Billedet viser atomstrukturen i kogsalt.
kuglesymmetriske ud fra en given ion f.eks Na+ vil den søge at omgive sig med ioner med modsat fortegn her Cl- på en symmetrisk måde indenfor de muligheder som pladsen tillader. Samtidigt skal det samlede slatkrystal have lige mange positive og negative ladninger. De ladede ioner fortættes i et gitter når det er fast stof, her noget man generelt kalder et kubisk gitter (atomerne sidder skiftevis Na og Cl som hjørner i enkasse som fortsætter i næste kasse udad, se figur. Stoffer med ionbindinger er i reglen opløselige i vand og ledende. Billedet viser atomstrukturen i kogsalt.
Atombinding
(Covalent binding) her er tale om, at nogle atomer er fælles om et eller flere elektronpar. Det der sker er opfyldning af de yderste elektronskaller til det maksimalt mulige som normalt er 8 elektroner. Her kræver den dybere forståelse kvantemekanik, og det var først i slutningen af 1920'erne at man fandt den endelige forklaring. 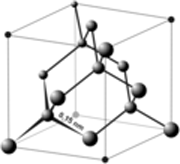 Denne binding findes i næsten alle organiske forbindelser, i form af endelige strukturer.
Denne binding findes i næsten alle organiske forbindelser, i form af endelige strukturer.
Her er tale om tiltrækning i bestemte retninger som så bestemmer hvordan atomerne sidder i forhold til hinanden, man taler om orbitaler. Ikke metaller har også atombindinger f.eks. Cl2, N2, S8. Det mest kendte stof af denne art er H2O, vand Diamanten er også bundet sammen med covalente bindinger i en uendelig struktur. Stoffer med atombindinger er normalt ikke opløselige i vand og ikke ledende. Billedet viser strukturen i en diamantkrystal.
Metalbinding
Metaller er karaktericeret ved stor elektrisk ledningsevne og varmeledningsevne. De er uigennemsigtige og har metalglans. Metalatomerne sidder bundet sammen som ioner og den/de overskydende elektroner de såkaldte valenselektroner udgør en "elektrongas" som frit kan bevæge sig i metallet og denne elektrongas giver såvel den elektriske- som varmeledningsevnen. Grunden til at atomerne i et metal hænger sammen er, at kvantemekanikken tillader at elektronerne 'delokaliserer', dvs de er ikke bundet til et enkelt atom. Igen ifølge kvantemekanikken har en delokaliseret elektron lavere energi end en elektron, der er lokaliseret.
 Denne energigevinst udgør det meste af bindingsenergien i et metal. Antallet af delokaliserede elektroner i et metal varierer, men er under alle omstændigheder meget stort. Hvis man har 108 g sølv har man i det stykke sølv 6*1023 elektroner som kan bidrage til metalbindingen og for den sags skyld til ledningsevnen. Metallets egenskaber afhænger meget af størrelsen af metalatomerne (ionradierne).
Denne energigevinst udgør det meste af bindingsenergien i et metal. Antallet af delokaliserede elektroner i et metal varierer, men er under alle omstændigheder meget stort. Hvis man har 108 g sølv har man i det stykke sølv 6*1023 elektroner som kan bidrage til metalbindingen og for den sags skyld til ledningsevnen. Metallets egenskaber afhænger meget af størrelsen af metalatomerne (ionradierne).
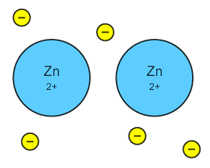
Metallerne er normalt opbygget så ionerne er så tæt på hinanden som muligt i "tætteste kuglepakning". I Princippet kan det opfattes som et ekstremt tilfælde af en Covalent binding. Disse elektroner som atomerne fælles om bevirker, at der er god termisk- og elektrisk ledningsevne af metaller. Billedet viser en zinkkrystal med fordelte fælles elektroner.
Van der Waalske bindinger
Her er tale om intermolekylære kræfter, som kan være imellem elektrisk neutrale molekyler eller atomer. Dette kan gælde såvel organiske som uorganiske forbindelser. Da enes ladninger frastøder hinanden og modsatte tiltrækker vil molekyler både frastøde og tiltrække hinanden. Det er forklaringen på at stoffer kan optræde flydende såvel som faste. Hvor der er tale om coulombske kræfter varierer kraften med r-2 ved disse bindinger er det meget svagere, variationen er som r-7. En fordobling af afstanden nedsætter kraften ved ioner med ¼ ved Van der Waals bindinger med ca. 1/100, det er altså kortrækkende kræfter. Temperatursvingninger vil derfor let kunne løsrive molekyler fra helheden.
For atombindinger og ionbindinger vil den energi der skal tilføres for at sprænge bindingen ofte være omkring 400 kJ/ mol (1 mol er 6*1023 atomer eller molekyler) evt. større eller ca. 4 eV (elektronvolt) pr molekyle, metalbindinge ligger omkring 40 - 80 kJ/mol, ca. 0,5 - 1eV og van der Waalske bindinger omkring 2-4 kj/mol eller 0,05 - 0,1 eV.
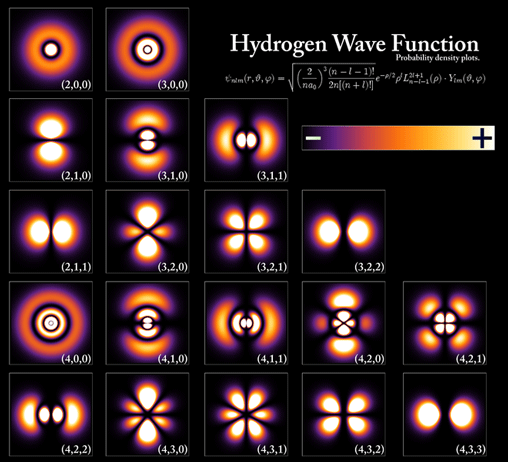
Billedet viser de såkaldte orbitaler omkring hydrogen (brint) hvor sansynligheden for elektroner er størst.
Med venlig hilsen
Per Hedegård
Malte Olsen
